铁的电子排布式,铁元素电子怎样分层排布?
铁是26号元素,位置在过渡元素区,不能简单的用主族元素的排布规律来分析。各层的排布情况:+26 2 8 14 2电子排布式为铁的电子排布式:1s2 2s2 2p6 3s2 3p6 3d6 4s2核外电子分层排布的规律1.原子核外电子分层排布的一般规律在含有多个电子的原子里,电子依能量的不同是分层排布的,其主要规律是:(1)核外电子总是尽先排布在能量较低的电子层,然后由里向外,依次排布在能量逐步升高的电子层(能量最低原理)。(2)原子核外各电子层最多容纳2n2个电子。(3)原子最外层电子数目不超过8个(K层为最外层时不能超过2个电子)。(4)次外层电子数目不能超过18个(K层为次外层时不能超过2个),倒数第三层电子数目不能超过32个。2.元素的性质与元素的原子核外电子排布的关系(1)稀有气体的不活泼性:稀有气体元素的原子最外层有8个电子(氦是2个电子),处于稳定结构,因此化学性质稳定,一般不跟其他物质发生化学反应。(2)非金属性与金属性(一般规律)3.原子的组成和三种粒子间的关系X的含义:代表一个质量数为A、质子数为Z的原子。质量数(A)=质子数(Z)+中子数(N)。核电荷数=元素的原子序数=质子数=核外电子数。
原子结构示意图 是用于表示元素原子的核电荷数和核外电子排布的图示.圆圈表示原子核,圈内的数字表示质子数目,“+”号表示质子带正电荷;弧线表示电子层,弧线上的数字表示该层上的电子数.铁原子的原子核有26个带正电的质子,核外有4个电子层,K层有2个电子,L层有8个电子,M层有14个电子,N层有2个电子.,铁的电子排布是1s(2)2s(2)2p(6)3s(2)3p(6)4s(2)3d(6)结构示意图为:
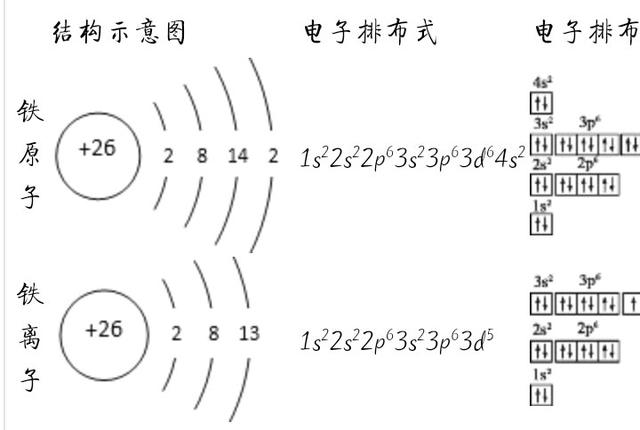
电子排布式和核外电子排布式不一样。电子排布式只关注与最外层电子的排布情况但是核外电子排布式关注的是核外所有电子的排布情况。
电子排布式是指用能级的符号及能级中容纳电子数值表达核外电子运动的状态,是表示原子核外电子排布的图式之一。电子排布式中的内层电子排布可用相应的稀有气体的元素符号加方括号来表示。
原子核外电子排布的原理:
处于稳定状态的原子,核外电子将尽可能地按能量最低原理排布,另外,由于电子不可能都挤在一起,它们还要遵守保里不相容原理和洪特规则,一般而言,在这三条规则的指导下,可以推导出元素原子的核外电子排布情况,在中学阶段要求的前36号元素里,没有例外的情况发生。
















